화학분석기사(2017. 9. 23.) 시험일자 : 2017년 9월 23일
1과목 : 일반화학
1. 존재 가능한 다른 구조의 다이브로모벤젠(dibromobenzene)은 몇 가지 종류인가?
- ① 2
- ② 3
- ③ 4
- ④ 5
등록된 댓글이 없습니다.
2. 화학식 C4H10O 로 존재할 수 있는 알코올의 구조이성질체는 몇 개인가?
- ① 3
- ② 4
- ③ 5
- ④ 7
해설2021. 9. 18. 11:11삭제
https://ywpop.tistory.com/19374
3. 3.84몰(mol)의 Na2CO3이 완전히 녹아 있는 수용액에서 나트륨이온(Na+)의 몰(mol)수로 옳은 것은?
- ① 1.92mol
- ② 3.84mol
- ③ 5.76mol
- ④ 7.68mol
등록된 댓글이 없습니다.
4. 222Rn 에 관한 내용 중 틀린 것은? (단, 222Rn 의 원자번호는 86 이다.)
- ① 양성자수 = 86
- ② 중성자수 = 134
- ③ 전자수 = 86
- ④ 질량수 = 222
등록된 댓글이 없습니다.
5. 용해도에 대한 설명 중 틀린 것은?
- ① 일정 압력하에서 물 속에서 기체의 용해도는 온도가 증가함에 따라 증가한다.
- ② 액체 속 기체의 용해도는 기체의 부분압력에 비례한다.
- ③ 탄산음료를 차갑게 해서 마시는 것은 기체의 용해도를 증가시키기 위함이다.
- ④ 잠수부들이 잠수할 경우 받는 압력의 증가로 인해 혈액 속의 공기의 양은 증가한다.
등록된 댓글이 없습니다.
6. 몰질량이 162g/mol 이며 백분율 질량 성분비가 탄소 74.0%, 수소 8.7%, 질소 17.3%인 화합물의 분자식은? (단, 탄소, 수소, 질소의 원자량은 각각 12.0amu, 수소 1.0amu, 14.0amu 이다.
- ① C11H16N
- ② C10H14N2
- ③ C9H26N4
- ④ C8H24N5
등록된 댓글이 없습니다.
7. 슈크로오스(C12H22O11) 684g을 물에 녹여 전체 부피를 4.0L 로 만들었을 때 이 용액의 몰농도(M)는?
- ① 0.25
- ② 0.50
- ③ 0.75
- ④ 1.00
등록된 댓글이 없습니다.
8. 암모니아 56.6g 에 들어있는 분자의 개수는? (단, N 원자량: 14.01g/mol, H 원자량: 1.008g/mol 이다.)
- ① 3.32×1023개 분자
- ② 17.03×1024개 분자
- ③ 6.78×1023개 분자
- ④ 2.00×1024개 분자
해설2021. 9. 18. 11:19삭제
https://ywpop.tistory.com/19375
9. 용액 내의 Fe2+ 의 농도를 알기 위해 적정 실험을 하였는데, 이 과정에 대한 설명 중 옳은 것은?
- ① 농도가 알려진 NH4+ 용액으로 색이 자주빛으로 변할 때까지 철 용액에 한 방울씩 떨어뜨린다.
- ② 농도가 알려진 NH4+ 용액으로 색이 무색으로 변할 때 까지 철 용액에 한 방울씩 떨어뜨린다.
- ③ 농도를 아는 MnO4- 용액으로 색이 자주빛으로 변할 때 까지 철 용액에 한 방울씩 떨어뜨린다.
- ④ 농도를 아는 MnO4- 용액으로 색이 무색으로 변할 때 까지 철 용액에 한 방울씩 떨어뜨린다.
등록된 댓글이 없습니다.
10. 다음 중 원자의 크기가 가장 작은 것은?
- ① K
- ② Li
- ③ Na
- ④ Cs
등록된 댓글이 없습니다.
11. N 의 산화수가 +4 인 것은?
- ① HNO3
- ② NO2
- ③ N2O
- ④ NH4Cl
등록된 댓글이 없습니다.
12. 용액의 조성을 기술하는 방법에 대한 설명 중 틀린 것은?
- ① 질량 퍼센트 : 용액 내에서 각 성분 물질의 질량 퍼센트로 정의한다.
- ② 몰농도 : 용액 1L 당 용질의 몰수로 정의한다.
- ③ 몰랄농도 : 용매 1Kg 당 용질의 몰수로 정의한다.
- ④ 몰분율 : 혼합물에서 한 성분의 몰분율이란 그 성분의 몰수를 해당 성분을 제외한 나머지 성분 전체의 몰수로 나눈 것이다.
등록된 댓글이 없습니다.
13. 메탄 2.80g 에 들어 있는 메탄 분자수는 얼마인가?
- ① 1.05 x 1022 분자
- ② 1.05 x 1023 분자
- ③ 1.93 x 1022 분자
- ④ 1.93 x 1023 분자
등록된 댓글이 없습니다.
14. 산과 염기에 대한 설명 중 틀린 것은?
- ① 산은 물에서 수소이온(H+)의 농도를 증가시키는 물질이다.
- ② 산과 염기가 반응하여 물과 염을 생성하는 반응을 중화반응이라고 한다.
- ③ 염기성 용액에서는 H+ 의 농도보다 OH- 의 농도가 더 크다.
- ④ 산성용액은 푸른 리트머스 시험지를 노랗게 변색시킨다.
등록된 댓글이 없습니다.
15. 다음 반응이 일어난다고 할 때 산화되는 물질은?

- ① Ag+(aq), Al3+(aq)
- ② Fe2+(aq), Mg(s)
- ③ Ag+(aq), Mg(s)
- ④ Fe2+(aq), Al3+(aq)
등록된 댓글이 없습니다.
16. 어떤 온도에서 다음 반응의 평형 상수 50 이다. 같은 온도에서 x몰의 H2(g)와 2.5몰의 I2(g)를 반응시켜 평형에 이르렀을 때 4몰의 HI(g) 가 되었고, 0.5몰의 I2(g)가 남아 있었다. x의 값은 얼마인가?

- ① 1.64
- ② 2.64
- ③ 3.64
- ④ 4.64
등록된 댓글이 없습니다.
17. alkene 에 해당하는 것은?
- ① C6H14
- ② C6H12
- ③ C6H10
- ④ C6H6
등록된 댓글이 없습니다.
18. 다음 무기화합물의 명칭에 해당하는 것은?

- ① 삼황산수소나트륨
- ② 황산수소나트륨
- ③ 과황산수소나트륨
- ④ 아황산수소나트륨
해설2021. 9. 18. 11:40삭제
https://ywpop.tistory.com/19376
19. 0.40M NaOH와 0.10 H2SO4를 1 : 1 부피로 섞었을 때, 이 용액의 pH는 얼마인가?
- ① 10
- ② 11
- ③ 12
- ④ 13
해설2021. 9. 18. 11:51삭제
https://ywpop.tistory.com/19377
20. 텔루륨(Te)과 요오드(I)의 이온화에너지와 전자친화도의 크기 비교를 옳게 나타낸 것은?
- ① 이온화에너지 : Te < I, 전자친화도 : Te < I
- ② 이온화에너지 : Te < I, 전자친화도 : Te > I
- ③ 이온화에너지 : Te > I, 전자친화도 : Te < I
- ④ 이온화에너지 : Te > I, 전자친화도 : Te > I
등록된 댓글이 없습니다.
2과목 : 분석화학
21. 부피 분석법인 적정법을 이용하여 정량 분석을 할 경우 다음 중 가장 옳은 설명은?
- ① 적정 실험에서 측정하고자 하는 당량점과 실험적인 종말점은 항상 일치한다.
- ② 적정 오차는 바탕 적정(blank titration)을 통해 보정할 수 있다.
- ③ 역적정 실험 시에는 적정 시약(titrant)을 시료에 가하면서 지시약의 색이 바뀌는 부피를 직접 관찰한다.
- ④ 무게 적정(gravimetric titration) 실험 시에는 적정 시약의 부피를 측정한다.
등록된 댓글이 없습니다.
22. 다음 화학평형식에 대한 설명으로 틀린 것은?

- ① 이 반응을 나타내는 평형상수는 Ksp 라고 하며 용해도상수 또는 용해도곱상수라고도 한다.
- ② 이 용액에 Cl- 이온을 첨가하면 용해도는 감소한다.
- ③ 온도를 증가시키면 Ksp 는 변한다.
- ④ 이 용액에 Cl- 이온을 첨가하면 Ksp 는 감소한다.
등록된 댓글이 없습니다.
23. 금속 킬레이트에 대한 설명으로 옳은 것은?
- ① 금속은 루이스(Lewis) 염기이다.
- ② 리간드는 루이스(Lewis) 산이다.
- ③ 한 자리(monodentate) 리간드인 EDTA는 6개의 금속과 반응한다.
- ④ 여러자리(multidentate) 리간드가 한 자리(monodentate) 리간드보다 금속과 강하게 결합한다.
해설2021. 9. 18. 17:33삭제
https://ywpop.tistory.com/19379
24. H+와 OH-의 활동도계수는 이온세기가 0.050M일 때는 각각 0.86 과 0.81 이었고, 이온세기가 0.10M 일 때는 각각 0.83 과 0.76 이었다. 25℃에서 0.10M KCl 수용액에서 H+의 활동도는?
- ① 1.00 x 10-7
- ② 1.05 x 10-7
- ③ 1.10 x 10-7
- ④ 1.15 x 10-7
등록된 댓글이 없습니다.
25. Cd2+ 이온이 4분자의 암모니아(NH3!)와 반응하는 경우와 2분자의 에틸렌디아민(H2NCH2CH2NH2)과 반응하는 경우에 대한 설명으로 옳은 것은?
- ① 엔탈피 변화는 두 경우 모두 비슷하다.
- ② 엔트로피 변화는 두 경우 모두 비슷하다.
- ③ 자유에너지 변화는 두 경우 모두 비슷하다.
- ④ 암모니아와 반응하는 경우가 더 안정한 금속착물을 형성한다.
등록된 댓글이 없습니다.
26. 다음 중 가장 센 산화력을 가진 산화제는? (단, E° 는 표준환원전위이다.)
- ① 세륨 이온(Ce4+), E° = 1.44V
- ② 크롬산 이온(CrO42-), E° = -0.12V
- ③ 과망간산 이온(MnO4-), E° = 1.507V
- ④ 중크롬산 이온(Cr2O72-), E° = 1.36V
등록된 댓글이 없습니다.
27. 산화환원 적정에서 과망간산칼륨(KMnO4)은 산화제로 작용하며 센 산성 용액(pH 1 이하)에서 다음과 같은 반응이 일어난다. MnO4-+8H++5e- ⇄ Mn2++4H2O E°=1.507V 과망간산칼륨을 산화제로 사용하는 산화환원 적정에서 종말점을 구하기 위한 지시약으로서 가장 적절한 것은?
- ① 페로인
- ② 메틸렌 블루
- ③ 과망간산칼륨
- ④ 다이페닐아민 설폰산
등록된 댓글이 없습니다.
28. EDTA 적정의 종말점을 검출하기 위한 방법이 아닌 것은?
- ① 금속이온 지시약
- ② 유리전극
- ③ 이온선택성 전극
- ④ 가리움제
등록된 댓글이 없습니다.
29. Fe2+이온을 Ce4+로 적정하는 반응에 대한 설명을 틀린 것은?
- ① 적정반응은 Ce4++Fe2+→Ce3++Fe3+ 이다.
- ② 전위차법을 이용한 적정에서는 반당량점에서의 전위는 당량점의 전위(Ve)의 약 1/2 이다.
- ③ 당량점에서 [Ce3+]=[Fe3+], [Fe2+]=[Ce4+] 이다.
- ④ 당량점 부근에서 측정된 전위의 변화는 미세하여 정확한 측정을 위해 산화-환원지시약을 사용해야 한다.
등록된 댓글이 없습니다.
30. 난용성 고체염인 BaSO4로 포화된 수용액에 대한 설명으로 틀린 것은?
- ① BaSO4 포화수용액에 황산 용액을 넣으면 BaSO4 가 석출된다.
- ② BaSO4 포화수용액에 소금물을 첨가 시에도 BaSO4 가 석출된다.
- ③ BaSO4 의 Ksp 는 온도의 함수이다.
- ④ BaSO4 포화수용액에 BaCl2 용액을 넣으면 BaSO4 가 석출된다.
등록된 댓글이 없습니다.
31. 산(acid)에 대한 일반적인 설명으로 옳은 것은?
- ① 알코올은 산성용액으로 알코올의 특징을 나타내는 OH의 H가 쉽게 해리된다.
- ② 페놀은 중성용액으로 OH의 H는 해리되지 않는다.
- ③ 물 속에서 H+는 H3O+로 존재한다.
- ④ 디에틸에테르는 산성 용액으로 H가 쉽게 해리된다.
등록된 댓글이 없습니다.
32. 무게분석을 위하여 침전된 옥살산칼슘(CaC2O4)을 무게를 아는 거름도가니로 침전물을 거르고, 건조시킨 다음 붉은 불꽃으로 강열한다면 도가니에 남는 고체성분은 무엇인가?
- ① CaC2O4
- ② CaCO2
- ③ CaO
- ④ Ca
등록된 댓글이 없습니다.
33. 전하를 띠지 않는 중성분자들은 이온세기가 0.1M 보다 작을 경우 활동도 계수(activity coefficient)를 얼마라고 할 수 있는가?
- ① 0
- ② 0.1
- ③ 0.5
- ④ 1
등록된 댓글이 없습니다.
34. 뉴스에서 A제과회사의 과자에서 발암물질로 알려진 아플라톡신이 기준치 10ppb 보다 높은 14ppb가 검출돼 전량 폐기했다고 밝혔다. 이 과자 1kg에서 몇 mg의 아플라톡신이 검출되었는가?
- ① 14g
- ② 1.4mg
- ③ 0.14mg
- ④ 0.014mg
등록된 댓글이 없습니다.
35. 다음 반응에서 ΔH° = -75.2J/mol, ΔS° = -132J/K·mol 일 때의 설명으로 옳은 것은?(단, ΔH° 와 ΔS° 각각 표준엔탈피 변화와 표준엔트로피 변화를 의미하며 온도에 관계없이 일정하다고 가정한다.
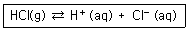
- ① 특정 온도보다 낮은 온도에서 자발적으로 진행될 가능성이 크다.
- ② 특정 온도보다 높은 온도에서 자발적으로 진행될 가능성이 크다.
- ③ 온도와 관계없이 항상 자발적으로 일어난다.
- ④ 온도에 관계없이 자발적으로 일어나지 않는다.
등록된 댓글이 없습니다.
36. 전지의 두 전극에서 반응이 자발적으로 진행되려는 경향을 갖고 있어 외부 도체를 통하여 산화전극에서 환원전극으로 전자가 흐르는 전지 즉, 자발적인 화학반응으로부터 전기를 발생시키는 전지를 무슨 전지라 하는가?
- ① 전해 전지
- ② 표준 전지
- ③ 자발 전지
- ④ 갈바니 전지
등록된 댓글이 없습니다.
37. 0.1M 의 Fe2+ 50mL를 0.1M 의 Tl3+ 로 적정한다. 반응식과 각각의 표준환원전위가 다음과 같을 때 당량점에서 전위(V)는 얼마인가?

- ① 0.94
- ② 1.02
- ③ 1.11
- ④ 1.20
등록된 댓글이 없습니다.
38. 녹말과 같은 고유 지시약을 제외한 일반 산화환원 지시약의 색깔 변화에 대한 설명으로 가장 옳은 것은?
- ① 산화환원 적정 과정에서 적정곡선의 모양이 거의 수직 상승하는 범위에 의존한다.
- ② 산화환원 적정에 참여하는 분석물과 적정시약의 화학적 성질에 의존한다.
- ③ 산화환원 적정 과정에서 생기는 계의 전극 전위의 변화에 의존한다.
- ④ 산화환원 적정 과정에 변하는 용액의 pH 변화에 의존한다.
등록된 댓글이 없습니다.
39. 25℃에서 0.028M 의 NaCN 수용액의 pH 는 얼마인가? (단, HCN 의 Ka = 4.9×10-10이다.)
- ① 10.9
- ② 9.3
- ③ 3.1
- ④ 2.8
해설2021. 9. 22. 17:47삭제
https://ywpop.tistory.com/6550
40. 초산(CH3COOH) 6g을 물에 용해하여 500mL용액을 만들었다. 이 용액의 몰농도(mol/L)는 얼마인가? (단, 초산의 분자량은 60g/mol 이다.)
- ① 0.1M
- ② 0.2M
- ③ 0.5M
- ④ 1.0M
등록된 댓글이 없습니다.
3과목 : 기기분석I
41. 원자스펙트럼의 선넓힘을 일으키는 요인으로 가장 거리가 먼 것은?
- ① 온도
- ② 압력
- ③ 자기장
- ④ 에너지준위
등록된 댓글이 없습니다.
42. 원자분광법에서 원자선 나비가 중요한 주된 이유는?
- ① 원자들이 검출기로부터 멀어져 발생되는 복사선 파장의 증폭을 방지할 수 있다.
- ② 다른 원자나 이온과의 충돌로 인한 에너지준위의 변화를 막을 수 있다.
- ③ 원자의 전이 시간의 차이로 발생되는 선 좁힘 현상을 제거할 수 있다.
- ④ 스펙트럼선이 겹쳐서 생기게 되는 분석방해를 방지할 수 있다.
등록된 댓글이 없습니다.
43. 230nm 빛을 방출하기 위하여 사용되는 광원으로 가장 적절한 것은?
- ① tungsten lamp
- ② deuterium lamp
- ③ nernst glower
- ④ globar
등록된 댓글이 없습니다.
44. IR spectrophotometer 에 일반적으로 가장 많이 사용되는 파수의 단위는?
- ① nm
- ② Hz
- ③ cm-1
- ④ rad
등록된 댓글이 없습니다.
45. 적외선 흠수분광기의 시료용기에 사용할 수 있는 재질로 가장 적합한 것은?
- ① 유리
- ② 소금
- ③ 석영
- ④ 사파이어
등록된 댓글이 없습니다.
46. 원자분광법에서 시료도입 방법에 따른 시료형태로서 틀린 것은?
- ① 직접주입 - 고체
- ② 기체 분무화 - 용액
- ③ 초음파 분무화 - 고체
- ④ 글로우 방전 튀김 - 전도성 고체
등록된 댓글이 없습니다.
47. UV-B를 차단하기 위한 햇볕차단제의 흡수 스펙트럼으로부터 280nm 부근의 흡광도가 0.38이었다면 투과되는 자외선 분율은?
- ① 42%
- ② 58%
- ③ 65%
- ④ 73%
등록된 댓글이 없습니다.
48. 530nm 파장을 갖는 빛의 에너지보다 3배 큰 에너지의 빛의 파장은 약 얼마인가?
- ① 177nm
- ② 226nm
- ③ 590nm
- ④ 1590nm
해설2023. 2. 27. 17:05삭제
https://ywpop.tistory.com/23225
49. 원적외선 영역의 파장(㎛) 범위는?
- ① 0.78 ~ 2.5
- ② 2.5 ~ 15
- ③ 2.5 ~ 50
- ④ 50 ~ 1000
참고2023. 2. 27. 17:11삭제
https://ywpop.tistory.com/8000
50. 원자흡수 분광법에서 스펙트럼 방해를 제거하는 방법이 아닌 것은?
- ① 연속광원보정
- ② 보호제를 이용한 보정
- ③ Zeeman효과 이용한 보정
- ④ 광원자체반전에 의한 보정
등록된 댓글이 없습니다.
51. Beer의 법칙에 대한 실질적인 한계를 나타내는 항목이 아닌 것은?
- ① 단색의 복사선
- ② 매질의 굴절률
- ③ 전해질의 해리
- ④ 큰 농도에서 분자간의 상호작용
등록된 댓글이 없습니다.
52. 적외선흡수분광법에서 적외선을 가장 잘 흡수할 수 있는 화학종은?
- ① O2
- ② HCl
- ③ N2
- ④ Cl2
해설2021. 9. 24. 10:47삭제
https://ywpop.tistory.com/19422
53. IR을 흡수하려면 분자는 어떤 특성을 가지고 있어야 하는가?
- ① 분자구조가 사면체이면 된다.
- ② 공명구조를 가지고 있으면 된다.
- ③ 분자 내에 π결합이 있으면 된다.
- ④ 분자 내에서 쌍극자 모멘트의 변화가 있으면 된다.
등록된 댓글이 없습니다.
54. 분산형 적외선(dispersive IR) 분광기와 비교할 때, Fourier 변환 적외선(FTIR) 분광기에서 사용되지 않는 장치는?
- ① 검출기(detector)
- ② 광원(light source)
- ③ 간섭계(interferometer)
- ④ 단색화장치(monochromator)
해설2021. 9. 24. 11:36삭제
https://ywpop.tistory.com/19424
55. 원자 X선 분광법에 이용되는 X선 신호변환기 중 기체충전변환기에 속하지 않는 것은?
- ① 증강 계수기
- ② 이온화 계수기
- ③ 비례 계수기
- ④ Geiger 관
등록된 댓글이 없습니다.
56. 양성자의 자기 모멘트 배열을 반대방향으로 변화시키는데 100MHz 의 라디오 주파수가 필요하다면 양성자 NMR 의 자석의 세기는 약 몇 T 인가? (단, 양성자의 자기회전비율은 3.0x108T-1s-1이다.)
- ① 2.1
- ② 4.1
- ③ 13.1
- ④ 23.1
등록된 댓글이 없습니다.
57. NMR기기에서 자석은 자기장과 관련이 있으므로 중요한 부품이다. 감도와 분해능이 자석의 세기와 질에 따라서 달라지므로 자장의세기를 정밀하게 조절하는 것이 중요하다. 다음중 NMR기기에서 사용되는 초전도자석 장치의 특징이 아닌 것은?
- ① 자기장의 균일하고 재현성이 높다.
- ② 초전도자석의 자기장이 일반 전자석보다 세다.
- ③ 전자석보다 복잡한 구조로 되어 있으므로 작동비가 많이 든다.
- ④ 초전도성을 유지하기 위해서 Nb/Sn 이나 Nb/Ti 합금선으로 감은 솔레노이드를 사용한다.
등록된 댓글이 없습니다.
58. 공장 인근의 해수에는 약 10mg/L 정도의 납(Pb)을 함유하고 있다. 유도결합플라스마방출분광법(ICP-AES)으로 해수 시료를 분석하고자 할 때 가장 적절한 분석 방법은?
- ① ICP-AES 로 분석하기 좋은 농도 법위이므로 전처리하지 않고 직접 분석한다.
- ② 해수에 염산(HCl)을 가하여 증발·농축시킨 후 질산으로 유기물을 분해시켜 ICP-AES 로 분석한다.
- ③ 해수 중의 유기물을 질산(HNO3)으로 분해시키고 NaCl(소금)매트릭스로부터 납(Pb)을 분리 후 분석한다.
- ④ 해수 중에는 NaCl 이 3% 정도 함유되어 있지만 Pb를 정량하는데 거의 영향을 주지 않으므로 유기물을 황산으로 분해시킨 후 직접 분석한다.
등록된 댓글이 없습니다.
59. 핵자기공명 분광학에서 이용하는 파장은?
- ① 적외선
- ② 자외선
- ③ 라디오파
- ④ microwave(마이크로웨이브)
해설2023. 2. 27. 17:15삭제
https://ywpop.tistory.com/19082
60. 나트륨은 589nm 와 589.6nm에서 강한 스펙트럼띠(선)를 나타낸다. 두 선을 구분하기 위해 필요한 분해능은?
- ① 0.6
- ② 491.2
- ③ 589.3
- ④ 982.2
등록된 댓글이 없습니다.
4과목 : 기기분석II
61. 다음 [그림]은 어떤 시료의 얇은 층 크로마토그램이다. 이 시료의 지연인자(retardation factor) Rf 값은?

- ① 0.10
- ② 0.20
- ③ 0.30
- ④ 0.50
등록된 댓글이 없습니다.
62. 질량분석기에서 사용하는 시료도입장치가 아닌 것은?
- ① 직접 도입장치
- ② 배치식 도입장치
- ③ 펠렛식 도입장치
- ④ 크로마토그래피 도입장치
등록된 댓글이 없습니다.
63. 원자질량분석장치 중에서 가장 상업화가 많이 되어 쓰이는 것은 ICP-MS이다. 이들 장치에 대한 설명으로 가장 바르게 설명한 것은?
- ① Ar을 이용한 사중극자 ICP-MS에서는 Fe, Se 등의 주 동위원소들이 간섭 없이 고감도로 측정이 잘된다.
- ② ICP와 결합된 Sector 질량분석장치는 고분해능이면서, Photon baffle이 필요 없어 고감도 기능을 유지한다.
- ③ Ar 플라즈마는 고온이므로 모두 완전히 분해되어 측정되므로 OH2+등의 polyatomic 이온에 의한 간섭이 없다.
- ④ Ar ICP는 고온의 플라스마이므로, F 등의 할로겐 원소들도 완전히 이온화시켜 측정할 수 있다.
등록된 댓글이 없습니다.
64. 갈바니전지에서 전류가 흐를 때 전위가 달라지는 요인으로 가장 거리가 먼 것은?
- ① 저항 전위
- ② 압력 과전압
- ③ 농도편극 과전압
- ④ 전하이동편극 과전압
등록된 댓글이 없습니다.
65. 초미립 세라믹 분말이나, 세라믹 분말로 만들어진 소재 및 부품들에 존재하는 금속원소들을 분석 시, 시료를 단일 산이나, 혼합 산으로 녹일 때 잘 녹지 않는 시료들이 많다. 이러한 경우네 시료를 전처리 없이 직접원자화 장치에 도입할 수 있는 방법은 여러 가지가 있다. 다음 중 고체 분말이나, 시편을 녹이지 않고 직접 도입하는 방법이 아닌 것은?
- ① 전열 가열법
- ② 레이저 증발법
- ③ fritted disk 분무법
- ④ 글로우방전법
등록된 댓글이 없습니다.
66. 일반적으로 사용되는 기체크로마토그래피의 검출기 중 보편적으로 사용되는 검출기가 아닌 것은?
- ① Refractive index detector(RI)
- ② Flame ionization detector(FID)
- ③ Electron capture detector(ECD)
- ④ Thermal conductivity detector(TCD)
등록된 댓글이 없습니다.
67. 액체크로마토그래피에 쓰이는 다음 용매 중 극성이 가장 큰 용매는?
- ① 물(water)
- ② 톨루엔(toluene)
- ③ 메탄올(metanol)
- ④ 아세토나이트릴(acetonitrile)
등록된 댓글이 없습니다.
68. 질량분석기의 이온화장치(ionization source)중 시료 분자 및 이온의 부서짐 및 토막내기(fragmentation)가 가장 많이 일어나는 것은?
- ① 장 이온화(field ionization)
- ② 화학 이온화(chemical ionization)
- ③ 전자충격 이온화(electron impact ionization)
- ④ 기질 보조 레이저 탈착 이온화(matrix-assisted laser desorption ionization)
등록된 댓글이 없습니다.
69. 폴리에틸렌에 포함된 카본블랙을 정량하고자 한다. 가장 알맞은 열분석법은?
- ① TGA
- ② DSC
- ③ DTA
- ④ TMA
등록된 댓글이 없습니다.
70. 다음 ( )안에 알맞은 용어는?

- ① 시린저
- ② 검출기
- ③ 정교하게 제작된 온도계
- ④ 감도가 매우 좋은 분석저울
등록된 댓글이 없습니다.
71. GLC에 사용되는 고체지지 물질(solid support)의 조건으로 적합하지 않은 것은?
- ① 단단해서 쉽게 깨지지 않아야 한다.
- ② 입자 모양과 크기가 불균일하여야 한다.
- ③ 단위체적당 큰 비표면적을 가져야 한다.
- ④ 액체 정지상을 쉽고 균일하게 도포할 수 있어야 한다.
등록된 댓글이 없습니다.
72. 다음 전지의 전위는?
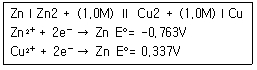
- ① -1.10V
- ② -0.427V
- ③ 0.427V
- ④ 1.10V
해설2021. 9. 24. 20:56삭제
https://ywpop.tistory.com/19430
73. 전기분석법이 다른 분석법에 비하여 갖고 있는 특징에 대하여 설명한 것 중 옳지 않은 것은?
- ① 기기장치가 비교적 저렴하다.
- ② 복잡한 시료에 대한 선택성이 있다.
- ③ 화학종의 농도보다 활동도에 대한 정보를 제공한다.
- ④ 전기화학측정법은 한 원소의 특정 산화상태에 따라 측정된다.
등록된 댓글이 없습니다.
74. 다음 중 기준전극으로 주로 사용되는 전극은?
- ① Cu/Cu2+전극
- ② Ag/AgCl 전극
- ③ Cd/Cd2+전극
- ④ Zn/Zn2+전극
등록된 댓글이 없습니다.
75. 순환 전압-전류법(Cyclic voltammetry)에 대한 설명으로 틀린 것은?
- ① 두 전극 사이에 정주사(forward scan) 방향으로 전위를 걸다가 역주사(Reverse scan)방향으로 원점까지 전위를 낮춘다.
- ② 작업전극의 표면적이 같다면, 전류의 크기는 펄스차이 폴라로그래피 전류와 거의 같다.
- ③ 가역반응에서는 양극봉우리 전류와 음극봉우리 전류가 거의 같다.
- ④ 가역반응에서는 양극봉우리 전위와 음극봉우리 전위의 차이는 0.0592/n volt 이다.
등록된 댓글이 없습니다.
76. 액체크로마토그래피에서 주로 이용되는 기울기용리(gradient elution)에 대한 설명으로 틀린 것은?
- ① 용매의 혼합비를 분석 시 연속적으로 변화시킬 수 있다.
- ② 분리시간을 크게 단축시킬 수 있다.
- ③ 극성이 다른 용매는 사용 할 수 없다.
- ④ 기체크로마토그래피의 온도변화 분석과 유사하다.
등록된 댓글이 없습니다.
77. 질량분석계의 질량분석 장치를 이용하는 방법에 해당되지 않는 분석기는?
- ① 원도 질량 분석기
- ② 사중극자 질량 분석기
- ③ 이중 초정 질량 분석기
- ④ 자기장 부채꼴 질량 분석기
등록된 댓글이 없습니다.
78. 아주 큰 분자량을 갖는 극성 생화학 고분자의 분자량에 대한 정보를 알 수 있는 가장 유용한 이온화법은?
- ① 장이온화(FI)
- ② 화학이온화(CI)
- ③ 전자충격이온화(EI)
- ④ 매트릭스지원 탈착 이온화(MALDI)
등록된 댓글이 없습니다.
79. 이온교환 크로마토그래피를 이용하여 음이온, 할로겐화물, 알칼로이드, 비타민 B 복합물 및 지방산을 분리하는데 가정 적절한 이온-교환 수지는?
- ① 강산성 양이온 - 교환수지
- ② 약산성 양이온 - 교환수지
- ③ 강염기성 음이온 - 교환수지
- ④ 약염기성 음이온 - 교환수지
등록된 댓글이 없습니다.
80. 2.00mmol 의 전자가 2.00V 의 전위차를 가진 전지를 통하여 이동할 때 행한 전기적인 일의 크기는 약 몇 J 인가? (단, Faraday 상수는 96500C/mol 이다.)
- ① 193J
- ② 386J
- ③ 483J
- ④ 965J
등록된 댓글이 없습니다.