화학분석기사(2015. 9. 19.) 시험일자 : 2015년 9월 19일
1과목 : 일반화학
1. 화학평형에 대한 다음 설명 중 옳은 것은?
- ① 화학평형이란 더 이상의 반응이 없음을 의미한다.
- ② 반응물과 생성물의 양이 같다는 것을 의미한다.
- ③ 정반응과 역반응의 속도가 같다는 것을 의미한다.
- ④ 정반응과 역반응이 동시에 진행되는 기가역반응이다.
등록된 댓글이 없습니다.
2. 에틸알콜(C2H5OH)의 융해열 4.81kJ/mol이라고 할 때 이 알콜 8.72g을 얼렸을 때의 △H는 약 몇 kJ인가?
- ① +0.9
- ② -0.9
- ③ +41.9
- ④ -41.9
밍2024. 7. 12. 22:22삭제
4.81*(8.72/46)
3. 다음 유기화합물의 명명이 잘못된 것은?
- ① CH3CHCICH3:2-chloropropane
- ② CH3-CH(OH)-CH3:2-propanol
- ③ CH3-O-CH2CH3:methoxyethane
- ④ CH3-CH2-COOH:propanone
ala2024. 7. 13. 18:18삭제
4. -COOH는 카복실기. ane-> –anoic acid으로 명명.
따라서 CH3-CH2-COOH: Propanoic acid(Propionic Acid)
(자세한설명: https://ywpop.tistory.com/13053)
- propanone = acetone
4. 아연-구리 전지에 대한 설명 중 틀린 것은?
- ① 볼타전지(또는 갈바니전지)의 대표적인 예이다.
- ② 구리이온이 산화되고 아연이 환원된다.
- ③ 염다리를 사용한다.
- ④ 질량이 증가하는 쪽은 구리전극 쪽이다.
등록된 댓글이 없습니다.
5. 다음 중 무기화합물에 해당하는 것은?
- ① C6H10
- ② NaHCO3
- ③ C12H22O11
- ④ CH3NH2
등록된 댓글이 없습니다.
6. 16.0M인 H2SO4 용액 8.00mL를 용액의 최종부피가 0.125L가 될 때까지 묽혔다면 묽힌 후 용액의 몰농도는 약 얼마가 되겠는가?
- ① 102M
- ② 10.2M
- ③ 1.02M
- ④ 0.102M
ala2024. 7. 13. 18:04삭제
16*0.008=0.128mol, M=0.128mol/0.125L=1.02 M
7. 3.5몰의 물을 전기분해하면 산소기체(O2) 몇 g이 생성되겠는가?
- ① 16
- ② 32
- ③ 56
- ④ 64
ala2024. 7. 13. 18:07삭제
2H2O-> 2H2+O2 , 즉 물 2몰이 생성되었을 때 산소기체 1몰이 생성.
(3.5/2)*32=56
8. 17Cl의 전자배치를 옳게 나타낸 것은?
- ① [Ar]3s23p6
- ② [Ar]3s23p5
- ③ [Ne]3s23p6
- ④ [Ne]3s23p5
등록된 댓글이 없습니다.
9. 주기율표상에서 나트륨(Na)부터 염소(Cl)에 이르는 3주기 원소들의 경향성을 옳게 설명한 것은?
- ① Na로부터 Cl로 갈수록 전자친화력은 약해진다.
- ② Na로부터 Cl로 갈수록 1차이온화에너지는 커진다.
- ③ Na로부터 Cl로 갈수록 원자반경은 커진다.
- ④ Na로부터 Cl로 갈수록 금속성이 증가한다.
등록된 댓글이 없습니다.
10. 산성비의 발생과 가장 관계가 없는 반응은?
- ① Ca2+(aq)+CO32-(aq)→CaCO3(s)
- ② S(s)+O2(g)→SO2(g)
- ③ N2(g)+O2(g)→2NO(g)
- ④ SO3(g)+H2O(L)→H2SO4(aq)
등록된 댓글이 없습니다.
11. 다음 반응에서 HCO3- 이온은 어떤 작용을 하는가?

- ① 오직 BrΦnsted-Lowry acid로만 작용한다.
- ② 오직 BrΦnsted-Lowry base로만 작용한다.
- ③ BrΦnsted-Lowry acid 및 BrΦnsted-Lowry base로 작용한다.
- ④ BrΦnsted-Lowry acid도 BrΦnsted-Lowry base 도 아니다.
ala2024. 7. 13. 18:54삭제
아레니우스/ 브뢴스테드로우리 / 루이스 순서로 설명
- 산: 물에녹아 H+내놓는 물질/H+를 내놓는 물질/e-를 받는 물질
- 염기: 물에녹아 OH- 내놓는 물질/ H+를 받는 물질/e-를 내놓는 물질
ala2024. 7. 13. 18:53삭제
아레니우스/ 브뢴스테드로우리 산의 차이는 "물에녹아"
12. 노르말 알케인(normal alkane)의 일반식은?
- ① CnH2n+1
- ② CnH2n
- ③ CnH2n+2
- ④ CnH2n-2
등록된 댓글이 없습니다.
13. 벤젠을 실험식으로 옳게 나타낸 것은?
- ① C6H6
- ② C6H5
- ③ C5H6
- ④ CH
ala2024. 7. 13. 18:57삭제
ex: 아세트산
-실험식: 간단한 정수비(ex: CH2O)
-화학식: 화합물의 구조 (ex: CH3COOH)
-시성식: 구조식 단순화한 형태 (작용기 표현) (ex: CH3COOH)
-분자식: 분자 내 원자 개수(ex: C2H4O2)
14. 산과 염기에 대한 설명으로 옳은 것은?
- ① 산은 붉은 리트머스 시험지를 푸르게 변화시킨다.
- ② 염기는 용액 내에서 수소이온(H+)을 생성하는 물질이다.
- ③ 산은 pH값이 7이상인 물질이다.
- ④ 산과 염기가 반응하면 염과 물이 생성된다.
ala2024. 7. 13. 18:59삭제
① 붉게
15. 백금 원자 1개의 질량은 몇 g인가? (단, 백금의 원자량은 195.09g/mol이다.)
- ① 3.24×10-23g
- ② 3.24×10-22g
- ③ 1.62×10-23g
- ④ 1.62×10-22g
ala2024. 7. 13. 19:07삭제
{195.09g/mol}/{(6.02*10^23)/mol}=3.24×10-22g
16. 몰(mole)에 대한 설명으로 틀린 것은?
- ① 1몰을 아보가드로 수만큼의 입자수를 의미한다.
- ② 1몰의 물질은 그램 단위의 원자량과 동일한 질량을 갖는다.
- ③ 1몰 산소 기체의 질량은 그 원소의 원자량과 같다.
- ④ 표준온도와 압력(STP) 상태에서 기체 1몰은 22.4L의 부피를 차지한다.
등록된 댓글이 없습니다.
17. 일정한 온도와 압력에서 진행되는 다음 연소반응에 관련된 내용을 틀리게 설명한 것은?
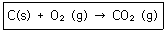
- ① 0.5몰의 탄소가 0.5몰의 산소와 반응하여 0.5몰의 이산화탄소를 만든다.
- ② 1그램의 탄소가 1그램의 산소와 반응하여 1그램의 이산화탄소를 만든다.
- ③ 이 반응에서 소비된 산소가 1몰이었다면, 생성된 이산화탄소의 몰수는 1몰이다.
- ④ 이 반응에서 1L의 산소가 소비되었다면 생성된 이산화탄소의 부피는 1L이다.
등록된 댓글이 없습니다.
18. 3.0M AgNO3 200mL를 0.9M CuCl2 350mL에 가해졌을 때, 생성되는 AgCl(분자량=143g)의 양은?
- ① 8.58g
- ② 45.1g
- ③ 85.8g
- ④ 451g
등록된 댓글이 없습니다.
19. 부탄이 공기 중에서 완전 연소하는 화학 반응식은 다음과 같다. 괄호 안에 들어갈 계수들 중 a의 값은 얼마인가?
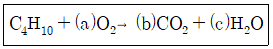
- ① 5
- ② 11/2
- ③ 6
- ④ 13/2
등록된 댓글이 없습니다.
20. 주어진 온도에서 N2O4(g)⇄2NO2(g)의 계가 평형상태에 있다. 이 때 계의 압력을 증가시키면 반응이 어떻게 진행되겠는가?
- ① 정반응과 역반응의 속도가 함께 빨라져서 변함없다.
- ② 평형이 깨어지므로 반응이 멈춘다.
- ③ 정반응으로 진행된다.
- ④ 역반응으로 진행된다.
ala2024. 7. 13. 19:10삭제
④ 분자수가 더 적은 역반응으로 반응진행
2과목 : 분석화학
21. 진한 염산에 HCl(분자량 36.46)이 무게비로 37.0wt% 있다. 이 염산의 밀도가 1.19g/mL 라면 몰 농도는 약 얼마인가?
- ① 6.1 M
- ② 12.1 M
- ③ 18.1 M
- ④ 24.1 M
ala2024. 7. 13. 22:12삭제
37% HCl 용액 100g 가정시 ,
37g HCl + 63g 물 = 100g HCl
(1)HCl 몰수 =37g / (36.46g/mol) = 1.0148mol
(2) 용액의 L수 = 100g / (1.19 g/mL) = 84.0336mL = 0.0840336L
(3) 몰농도 = (1)/(2) = 12.1M
22. KH2PO4와 KOH로 구성된 혼합용액의 전하균형식으로 옳은 것은?
- ① [H+]+[K+]=[OH-]+[H2PO4-]+2[HPO42-]+3[PO43-]
- ② 2[H+]+[K+]=[OH-]+[H2PO4-]+2[HPO42-]+3[PO43-]
- ③ [H+]+[K+]=[OH-]+[H2PO4-]+[HPO42-]+3[PO43-]
- ④ 2[H+]+[K+]=[PO43-]
ala2024. 7. 13. 22:16삭제
1)+는 +끼리, -는 -끼리
2) 전하 계수를 앞에 붙임
해설2021. 8. 25. 11:35삭제
https://ywpop.tistory.com/19188
23. 요로드화 반응에 대한 설명 중 틀린 것은?
- ① 요오드를 적정액으로 사용한다는 것은 l2에 과량의 l-가 첨가된 용액을 사용함을 의미한다.
- ② 요오드화 적정의 지시약으로 녹말지시약을 사용할 수 있다.
- ③ 간접요오드 적정법에는 환원성 분석물질을 미량의 l-에 가하여 요오드를 생성시킨 다음 이것을 적정한다.
- ④ 환원성 분석물질이 요오드로 직접 측정되었을 때, 이 방법을 직접 요오드적정법이라 한다.
ala2024. 7. 13. 22:27삭제
③ 간접요오드 적정법은 "산화성" 분석물질
- 직접 요오드 적정법: 강한 환원제들이 시료가됨. 요오드가 산화제로 작용.
- 간접요오드 적정법: 시료가 강한 산화제일 경우 사용함.
24. 표준 수소 전극에서의 반응 및 표준 전위(E°)를 가장 옳게 나타낸 것은?
- ① 2H+(A=1)+2e-⇄H2(A=2) E°=0.0V
- ② 2H+(A=2)+2e-⇄H2(A=1) E°=0.0V
- ③ 2H+(A=1)+2e-⇄H2(A=1) E°=0.0V
- ④ 2H+(A=2)+2e-⇄H2(A=2) E°=0.0V
등록된 댓글이 없습니다.
25. 다음 수용액들의 농도는 모두 0.1M이다. 이온세기(ionic strength)가 가장 큰 것은?
- ① NaCl
- ② Na2SO4
- ③ Al(NO3)3
- ④ MgSO4
ala2024. 7. 13. 23:02삭제
I = 1/2 Σ cᵢ zᵢ²
(cᵢ= 이온의 몰농도, zᵢ=이온전하)
① I = 1/2 [(0.1)* 1+ (0.1) *1] = 0.1
② I = 1/2 [ 2*(0.1)*1 + (0.1) *4] = 0.3 (Na이온=2개)
③ I = 1/2 [(0.1)*9 + 3* (0.1) *1] = 0.6 (NO_3이온=3개)
④ I = 1/2 [(0.1)*4 + (0.1) *4] = 0.4
26. 25℃에서 0.050M 트리메틸아민(Trimethylamine) 수용액의 pH는 얼마인가? (단, 25℃에서 (CH3)3NH+의 Ka 값은 1.58×10-10이다.)
- ① 5.55
- ② 7.55
- ③ 9.25
- ④ 11.25
ala2024. 7. 13. 23:01삭제
Kb = Kw / Ka = (10⁻¹⁴) / (1.58×10⁻¹⁰)= 6.33×10⁻⁵
(CH₃)₃N + H₂O ⇌ (CH₃)₃NH⁺+ OH⁻
Kb = [(CH₃)₃NH⁺][OH⁻] / [(CH₃)₃N] = 6.33×10⁻⁵
= (x)(x) / (0.050 – x) = 6.33×10⁻⁵
0.050-x를 0.050라 가정하면, x= 0.00178
pOH = -log[OH⁻] = -log(0.00178) = 2.75
pH=14-2.75=11.25
27. 무게분석법에서 결정을 성장시키는 방법으로 틀린 것은?
- ① 용해도를 증가시키기 위해 온도를 서서히 올린다.
- ② 침전제를 가급적 빨리 가한다.
- ③ 침전제를 가할 때 잘 저어준다.
- ④ 가급적 침전제의 농도를 낮게 하여 침전시킨다.
등록된 댓글이 없습니다.
28. 침전적정에서 종말점을 검출하는 데 일반적으로 사용하는 방법이 아닌 것은?
- ① 전극
- ② 지시약
- ③ 빛의 산란
- ④ 리트머스 시험지
등록된 댓글이 없습니다.
29. Fe3+을 포함하는 시료 10mL를 0.02M EDTA 20mL와 반응시켰다. 이 때 Fe3+는 모두 착물을 형성했고 EDTA는 과량으로 남게 된다. 과량의 EDTA는 0.05M Mg2+ 용액 3mL로 역적정하였다. 원래 시료 용액 중에 있는 Fe3+의 몰농도는?
- ① 0.025M
- ② 0.050M
- ③ 0.25M
- ④ 0.50M
ala2024. 7. 14. 15:24삭제
(1) EDTA 몰수= 0.02M*0.020L=4*10⁻⁴ mol
(2) Mg²⁺ 몰수= 0.05M*0.003L=1.5*10⁻⁴ mol
(3) Fe³⁺ 몰수= (1)-(2)= 2.5*10⁻⁴ mol
(4) Fe³⁺ 몰농도=(2.5*10⁻⁴) mol/0.010L=0.025M
30. 활동도계수의 특성에 대한 설명으로 가장 거리가 먼 것은?
- ① 용액이 무한히 묽어짐에 따라 주어진 화학종의 활동도계수는 1로 수렴한다.
- ② 농도가 높지 않은 용액에서 주어진 화학종의 활동도계수는 전해질의 종류에 따라서만 달라진다.
- ③ 주어진 이온세기에서 같은 전하를 가진 이온들의 활동도계수는 거의 같다.
- ④ 전하를 띠지 않은 분자의 활동도계수는 이온세기에 관계없이 대략 1이다.
ala2024. 7. 13. 23:05삭제
온도에도 영향받음
31. pH 10인 완충 용액에서 0.0360 M Ca2+ 용액 50.0mL를 0.0720M EDTA로 적정할 경우에 당량점에서의 칼슘 이온의 농도 [Ca2+]는 얼마인가? (단, 조건 형성 상수(conditional formation constant) Kㆍf값은 1.34×1010이다.)
- ① 0.0240M
- ② 1.34×10-6 M
- ③ 1.64×10-6 M
- ④ 1.79×10-12 M
ala2024. 7. 14. 15:14삭제
Ca²⁺의 몰수= 0.0360*0.050=1.8*10⁻³mol
당량점에서 CaY²⁻ 몰농도=(1.8*10⁻³)mol / (0.050+0.025)L = 0.024M
Kㆍf= (0.024-x)/(x*x)=0.024/x²=1.34*10¹⁰
x=1.34*10⁻⁶
32. 다음 반응에 대한 화학평형상수 K를 옳게 나타낸 것은?

- ①
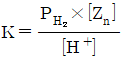
- ②
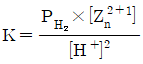
- ③
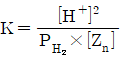
- ④

등록된 댓글이 없습니다.
33. 다음 평형반응에 대한 Kb는 얼마인가? (단, HCN의 Ka의 값은 6.20×10-10이다.)
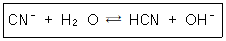
- ① 1.61×10-5
- ② 1.54×10-6
- ③ 1.73×10-5
- ④ 1.45×10-6
ala2024. 7. 13. 23:21삭제
Kb = Kw / Ka = (10⁻¹⁴)/(6.20×10⁻¹⁰)= 1.61×10⁻⁵
34. Mn2+가 들어 있는 시료용액 50mL를 0.1 M EDTA 용액 100mL와 반응시켰다. 모든 Mn2+와 반응하고 남은 여분의 EDTA를 금속지시약을 사용하여 0.1M Mg2+ 용액으로 적정하였더니 당량점까지 50mL가 소비되었다. 시료용액에 들어있는 Mn2+의 농도는 몇 M인가?
- ① 0.1
- ② 0.2
- ③ 0.3
- ④ 0.4
ala2024. 7. 14. 15:40삭제
(1) 초기 EDTA 몰수= 0.1M*0.100L=0.01mol
(2) Mg²⁺ 몰수= 0.1M*0.050L=0.005mol
(3) 남은 EDTA= (1)-(2)=0.005mol,
즉, Mg²⁺적정 전 Mn²⁺이 0.005mol만큼 반응했었음.
(4) Mn²⁺의 농도= 0.005mol/0.050L=0.1M
35. 강산이나 강염기로만 되어 있는 것은?
- ① HCl, HNO3, NH3
- ② CH3COOH, HF, KOH
- ③ H2SO4, HCl, KOH
- ④ CH3COOH, NH3, HF
등록된 댓글이 없습니다.
36. F-는 Al3+에는 가리움제(masking agent)로 작용하지만 Mg2+에는 반응하지 않는다. 어떤 미지시료에 Mg2+와 Al3+이 혼합되어 있다. 이 미지시료 20.0mL를 0.0800M EDTA로 적정하였을 때 50.0mL가 소모되었다. 같은 미지시료를 새로 20.0mL 취하여 충분한 농도의 KF를 5.00mL 가한 후 0.0800M EDTA로 적정하였을 때는 30.0mL가 소모되었다. 미지시료 중의 Al3+ 농도는?
- ① 0.080M
- ② 0.096M
- ③ 0.104M
- ④ 0.120M
ala2024. 7. 13. 23:33삭제
EDTA는 1가 양이온 제외하고 금속과 1:1로 반응
(1) F-넣지않고 EDTA로 적정= Mg2+, Al3+
소모된 EDTA 몰수= Mg2+, Al3+ 몰수= 0.08 mol/L x 0.05L = 4 x 10⁻³mol
(2) F- 를 넣고 EDTA로 적정 = Mg2+
소모된 EDTA 몰수= Mg2+ 몰수= 2.4 x 10⁻³mol
(3) Al3+ 몰수 = (1)-(2)=1.6 x 10⁻³
(4) Al3+ 몰농도 = 1.6 x 10⁻³ / 0.020 = 0.080M
37. 0.01M 염산 수용액의 pH는?
- ① 0.01
- ② 0.1
- ③ 2
- ④ -2
ala2024. 7. 13. 23:35삭제
pH = -log[H⁺] = -log (0.01) = 2
38. 산화-환원 지시약의 색깔이 변하는 전위 범위는? (단, n은 반응에 참여하는 전자의 수이다.)
- ① E=E°± (0.05916/n) V
- ② E=E°± 1.0V
- ③ E=E°± 0.05916 V
- ④ E=E°± 0.05916n V
등록된 댓글이 없습니다.
39. 다음 중 단위를 잘못 나타낸 것은?
- ① 주파수 : Hz
- ② 힘 : N
- ③ 일률 : J
- ④ 잔기량 : C
ala2024. 7. 13. 23:44삭제
③ 일률 : W, 에너지: J
40. 미지시료 내의 특정 물질의 양을 분석하는 방법으로 적정이 사용된다. 적정의 요건으로 틀린 것은?
- ① 적정에서의 반응은 느려도 크게 상관없다.
- ② 반응은 화학양론적이어야 한다.
- ③ 부반응이 없어야 한다.
- ④ 반응이 진행되어 당량점부근에서 용액의 어떤 성질에 변화가 일어나야 한다.
등록된 댓글이 없습니다.
3과목 : 기기분석I
41. 유기분자의 구조 및 작용기에 대한 정보를 적외선(IR)흡수 분광스펙트럼으로부터 얻을 수 있다. 적외선 흡수분광법에 대한 설명으로 틀린 것은?
- ① 결합전자전이가 허용된 결합만 흡수피크로 나타난다.
- ② 쌍극자모멘트의 변화가 있어야 흡수피크로 나타난다.
- ③ 적외선 흡수 측정을 위하여 간섭계를 사용한 Fourier 변환분광기를 주로 사용한다.
- ④ 파이로 전자검출기는 특별한 열적 및 전기적 성질을 가진 황산트리글리신 박편으로 만든다.
등록된 댓글이 없습니다.
42. ICP(유도결합플라즈마) 분광법에서 통상 사용되는 토치는 보통 3가지의 도입이 일어나는 관으로 구성된다. 다음 중 그 구성이 아닌 것은?
- ① 산화제 도입구
- ② 냉각 기체 도입구
- ③ 플라즈마 기체 도입구
- ④ 시료 에어로졸 도입구
등록된 댓글이 없습니다.
43. X-선 회절기기에서 토파즈(격차간격 d=1.356Å)가 회절 결정으로 사용되는 경우 Ag의 Ka1선인 0.497Å을 관찰하기 위해서는 측각기(goniometer) 각도를 몇 도에 맞추어야 하는가? (단, 2θ 값을 계산한다.)
- ① 10.6
- ② 14.2
- ③ 21.1
- ④ 28.4
ala2024. 7. 14. 14:45삭제
nλ=2dsinθ
1*0.497=2*1.356sinθ
0.1832=sinθ , 2θ=21.1
44. 들뜬 단일항 상태와 들뜬 삼중항 상태에 대한 설명 중 틀린 것은?
- ① 모든 전자스핀이 짝지어 있는 분자의 전자상태를 단일항 상태라고 하며, 이 분자가 자기장에 놓이는 경우에도 전자의 에너지 준위는 분리되지 않는다.
- ② 분자에 있는 전자쌍 중의 전자 하나가 보다 높은 에너지 준위로 들뜨면 전자의 에너지 상태는 단일항 상태 또는 삼중항 상태로 된다.
- ③ 들뜬 단일항 상태의 경우 들뜬 전자의 스핏은 바닥상태의 전자처럼 여전히 짝지어 있지만 삼중항 상태에서는 두 개의 전자스핀이 짝짓지 않고 평행하게 존재한다.
- ④ 전자스핀의 변화와 함께 일어나는 단일항-삼중항 상태의 전이는 단일항-단일항 상태 전이 보다 일어날 가능성이 더 크므로 들뜬 삼중항 상태에서의 전자 수명이 길다.
등록된 댓글이 없습니다.
45. Lambert-Beer 법칙을 나타내는 다음 수식(A=εbc)의 각 요소에 대한 설명 중 틀린 것은?
- ① ε는 물흡수광계수이다.
- ② c는 빛의 속도를 나타낸다.
- ③ b는 시료의 두께를 나타낸다.
- ④ A는 흡광도를 나타내며 상수항이다.
등록된 댓글이 없습니다.
46. 기기 부분장치의 표면에서 생기는 산란과 반사에 의해 주로 발생하는 떠돌이 빛(stray light)은 Beer의 법칙에서 어긋나는 요인이 된다. 떠돌이 빛에 의한 영향으로 옳은 것은?
- ① 흡광도가 클 때 큰 오차를 나타낸다.
- ② 흡광도가 작을 때 더 큰 오차를 나타낸다.
- ③ 흡광도와 관계없이 일정한 오차를 나타낸다.
- ④ 겉보기 흡광도가 실제 흡광도보다 항상 크게 나타난다.
등록된 댓글이 없습니다.
47. 전형적인 분광기기의 구성장치가 아닌 것은?
- ① 분리용 관
- ② 복사선 검출기
- ③ 안정한 복사에너지 광원
- ④ 제한된 스펙트럼 영역을 제공하는 장치
등록된 댓글이 없습니다.
48. 원자흡수 분광법을 이용하여 특별하게 수은(Hg)을 정량하는 데 사용되는 가장 적합한 방법은?
- ① 찬 증기 원자화법
- ② 불꽃 원자화 장치법
- ③ 흑연로 원자화 장치법
- ④ 금속 수소화물 발생법
등록된 댓글이 없습니다.
49. 불꽃을 사용하는 원자화 장치에서 공기-아세틸렌가스 대신 산화이질소-아세틸렌가스를 사용하게 되면 주로 어떤 효과가 기대되는가?
- ① 붗꽃의 온도가 감소한다.
- ② 불꽃의 온도가 증가한다.
- ③ 가스 연료의 비용이 줄어드나.
- ④ 시료의 분무 효율이 증가한다.
등록된 댓글이 없습니다.
50. 원자분광법의 시료도입방법 중 고체시료에 전처리 없이 직접 사용할 수 있는 방법은?
- ① 기체 분무화법
- ② 수소화물 생성법
- ③ 레이저 증발법
- ④ 초음파 분무화법
등록된 댓글이 없습니다.
51. 적외선 흡수분광법에서 지문영역은?
- ① 600~1200cm-1
- ② 1200~1800cm-1
- ③ 1800~2800cm-1
- ④ 2800~3600cm-1
등록된 댓글이 없습니다.
52. 유도결합플라즈마 광원인 토치(torch)의 불꽃에서 운도 분포를 적절하게 나타낸 것은?
- ① 유도코일 근처에서 온도가 가장 낮다.
- ② 불꽃의 제일 앞쪽에서 온도가 가장 높다.
- ③ 불꽃의 앞 끝으로부터 유도코일로 갈수록 온도는 높아진다.
- ④ 불꽃의 제일 앞 끝과 유도코일의 중간지점 근처에서 온도가 가장 높다.
등록된 댓글이 없습니다.
53. 여러 가지의 전자전이가 일어날 때 흡수하는 에너지(△E)가 가장 작은 것은?
- ① n→π*
- ② n→σ*
- ③ π→π*
- ④ σ→σ*
등록된 댓글이 없습니다.
54. 다이아몬드 기구에 의해 많은 수의 평행하고 조밀한 간격의 홈을 가지도록 만든 단단하고, 광학적으로 평평하고, 깨끗한 표면으로 구성된 장치는?
- ① 간섭필터
- ② 회절발
- ③ 간섭쐐기
- ④ 광전증배관
등록된 댓글이 없습니다.
55. 공기 중에서 파장 500nm, 진동수 6.0×1014Hz, 속도 3.0×108m/s, 광자(photon)의 에너지 4.0×10-19인 빛이 굴절률 1.5인 투명한 액체 속을 통과할 때의 설명으로 옳지 않은 것은?
- ① 파장은 500m이다.
- ② 속도는 2.0×108m/s이다.
- ③ 진동수는 6.0×1014Hz이다.
- ④ 광자의 에너지는 4.0×10-19J이다.
ala2024. 7. 14. 16:01삭제
① 파장= 2πv(속도)/v(진동수)= 2094nm
② 속도= 공기중속도 / 굴절률 = (3*10⁸) / 1.5 = 2.0*10⁸ m/s
③,④ 진동수와 광자의 에너지는 굴절률과 관계없음
56. 분자발광분광법에서 사용되는 용어에 대한 설명 중 틀린 것은?
- ① 내부전환-들뜬 전자가 복사선을 방출하지 않고 더 낮은 에너지의 전자상태로 전이하는 분자 내부의 과정
- ② 계간전이-다른 다중성의 전자상태 사이에서 교차가 일어나는 과정
- ③ 형광-들뜬 전자가 계간전이를 거쳐 삼중항 상태에서 바닥상태로 떨어지면서 발광
- ④ 외부전환-들뜬 분자와 용매 또는 다른 용질 사이에서의 에너지 전이
등록된 댓글이 없습니다.
57. ClCH2aCHb(CH3c)2 분자의 고분해능 1H-핵자기공명분광 1차 스펙트럼에서 a, b 및 c 수소 봉우리의 다중도는?
- ① 2, 9, 2
- ② 9, 8, 5
- ③ 2, 9, 8
- ④ 2, 21, 2
ala2024. 7. 14. 16:09삭제
다중도=(n+1) 이용 / ClCH₂ᵃCHᵇ(CH₃ᶜ)₂
a 다중도= b 수소 1개→ (1+1) = 2
b 다중도= a 수소 2개 + c 수소 6개 → (2+1) x (6+1) = 21
c 다중도= b 수소 1개→ (1+1) = 2
58. 단색 X-선 빛살의 광자가 K-껍질 및 L-껍질의 내부전자를 방출시켜 스펙트럼을 얻음으로써 시료원자의 구성에 대한 정보와 시료구성 성분의 구조와 산화상태에 대한 정보를 동시에 얻을 수 있는 전자스펙트럼법은?
- ① Auger 전자분광법(AES)
- ② X-선 광전자분광법(XPS)
- ③ 전자에너지 손실 분광법(EELS)
- ④ 레이저마이크로탐침 질량분석법(LMMS)
등록된 댓글이 없습니다.
59. 분자 에너지는 병진(translation), 진동(vibration), 회전(rotation), 전자(electronic)에너지 등으로 구분된다. 이들 중 연속적 변화를 나타내는 것은?
- ① 진동에너지
- ② 전자에너지
- ③ 병진에너지
- ④ 회전에너지
등록된 댓글이 없습니다.
60. 13C-NMR의 특징에 대한 설명으로 틀린 것은?
- ① H-NMR보다 검출이 매우 용이하다.
- ② 분자골격에 대한 정보를 얻을 수 있다.
- ③ 화학적 이동이 넓어서 봉우리의 겹침이 적다.
- ④ 탄소들 사이의 짝지음이 잘 일어나지 안는다.
등록된 댓글이 없습니다.
4과목 : 기기분석II
61. 질량분석법에서 이온화 방법에 대한 설명으로 옳은 것은?
- ① 화학온화방법을 사용하면 (M-1)+ 봉우리를 관찰할 수 없다.
- ② 전자충격이온화방법은 약한 이온원으로 분자이온 봉우리 관찰이 용이하다.
- ③ 장이온화법은 센 이온원으로 분자이동 봉우리를 관찰하기 힘들다.
- ④ 매트릭스-지원레이저탈착/이온화법의 경우 고질량(m/z) >10,000) 고분자를 관찰하는데 사용된다.
등록된 댓글이 없습니다.
62. 용액 속에서 전해 반응으로 생성시킨 l2를 이용하면 그 용액 속에 함께 존재하는 H2S(aq)의 농도를 분석할 수 있다. 50.0mL의 H2S(aq) 시료에 Kl 4g을 가한 후 52.6mA의 전류로 812초 동안 전해하였더니 당량점이 도달하였다, H2S 시료 용액의 농도는? (단, 원소의 원자량은 S=32.066, K=39.098, l=126.904, H=1.077이다.)

- ① 0.443mM
- ② 0.885mM
- ③ 4.43mM
- ④ 8.85mM
ala2024. 7. 14. 17:09삭제
(1) Q(전하량)=I(전류)*t(시간)=0.0526A*812S=42.7112C
반응식을 보면, H₂S와 e-가 1:2 몰수비로 반응함을 알 수 있음
(2) 즉, 42.7112C 전하량이 흘렀다면, H₂S는 (1/2) 해주면 됨.
H₂S 몰수= 42.7112C *(1/2) *(1mol/96485C) =2.213*10⁻⁴
H₂S 농도= (2.213*10⁻⁴)mol/ 0.050L = 4.43 *10⁻³M
63. 유도결합 플라즈마 질량분석법에서의 방해작용이 아닌 것은?
- ① 떠돌이빛 방해
- ② 이중하전이온 방해
- ③ 다원자이온 방해
- ④ 동중핵이온 방해
등록된 댓글이 없습니다.
64. 질량 분석법의 질량스펙트럼에서 알 수 있는 가장 유효한 정보는?
- ① 분자량
- ② 중성자의 무게
- ③ 음이온의 무게
- ④ 자유 라디칼의 무게
등록된 댓글이 없습니다.
65. 기체크로마토그래피법에서 시료주입법에 대한 설명으로 가장 옳은 것은?
- ① 분할 주입법은 고농도 시료나 기체 시료에 좋으며, 정량성도 매우 좋다.
- ② 분할 주입법은 분리도가 떨어지며, 불순물이 많은 시료를 다룰 수 있다.
- ③ 비분할 주입법은 희석된 용액에 적합하고 주입되는 동안 휘발성화합물이 손실되므로 정량분석으로 좋지않다.
- ④ on-column 주입법은 정량분석에 가장 적합하고 분리도가 높으나, 열에 민감한 화합물에는 좋지 않다.
등록된 댓글이 없습니다.
66. 열 분석법인 DTA(시차열법분석)와 DSC(시차주사열량법)에서 물리ㆍ화학적 변화로서 흡열 봉우리가 나타나지 않는 경우는?
- ① 녹음이나 용융
- ② 탈착이나 탈수
- ③ 증발이나 기화
- ④ 산소의 존재 하에서 중합반응
등록된 댓글이 없습니다.
67. 황산구리 수용액을 전기분해하면 음극에서는 구리가 석출되고, 양극에서는 산소가 발생한다. 0.5A의 전류로 1시간 동안 전기분해했을 때, 양극에서 발생하는 산소의 부피(mL)는 표준상태에서 약 얼마인가? (단, 두 전극의 반쪽반응은 다음과 같다.)
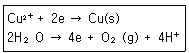
- ① 56
- ② 104
- ③ 112
- ④ 224
ala2024. 7. 14. 19:07삭제
(1)Q=I(전류)*t(시간)=0.5A*3600s=1800C
(2) 구리1몰 생성 시 e- 2몰 사용 → Cu : e- = 1: 2 , e-는 1몰당 96485C
Cu²⁺몰수 = 1800C *(1/2)*(1mol/96485C)= 9.33*10⁻³ mol
(3) 구리와 산소 몰수 비 =2:1
O₂ 몰수 = (9.33*10⁻³ mol)* (1/2) = 4.665*10⁻³ mol
(4) 기체 1mol이 표준상태에 있을 때 부피=22.4L
O₂ 부피 = ( 4.665*10⁻³) mol * 22.4L= 0.104L=104mL
68. 전기량법은 전극에서 충분히 산화 및 환원반응이 일어나게 시간을 주는 방법으로, 이러한 방법 중 많은 양의 분석에 적당한 방법은?
- ① 전기무게 분석법
- ② 일정전위 전기량법
- ③ 일정전류 전기량법
- ④ 전기량 적정법
등록된 댓글이 없습니다.
69. 기체-고체 크로마토그래피(GSC)는 기체 크로마토그래피의 일종으로 이동상 기체를, 고정상으로는 고체를 사용하는 경우를 일컫는다. 이 때 이동상과 고정상 사이에서 분석물의 어떤 상호작용이 분리에 기여하는가?
- ① 분배(Partition)
- ② 흡착(Adsorption)
- ③ 흡수(Absorption)
- ④ 이온교환(Ion Exchange)
등록된 댓글이 없습니다.
70. 선택 인자(selectivity factor, α)의 변화요인으로 가장 거리가 먼 것은?
- ① 컬럼의 온도 변화
- ② 시료의 주입량 변화
- ③ 이동상의 조성 변화
- ④ 정지상의 조성 변화
등록된 댓글이 없습니다.
71. 질량분석법을 여러 가지 성분의 시료를 기체 상태로 이온화한 다음 자기장 혹은 전기장을 통해 각 이온을 질량/전하의 비에 따라 분리하여 질량스펙트럼을 얻는 방법이다. 질량분석기의 기기장치 중 진공으로 유지되어야 하는 부분이 아닌 것은?
- ① 이온화장치
- ② 질량분리기
- ③ 검출기
- ④ 신호처리기
등록된 댓글이 없습니다.
72. 유기화합물의 혼합 용액을 기체 크로마토그래피로 분리하여 다음과 같은 데이터를 얻었다. 화합물의 머무름지수를 표시한 것 중 가장 거리가 먼 것은?

- ① n-Butane, 400
- ② 2-Butane, 431
- ③ Toluene, 726
- ④ n-Heptane, 761
ala2024. 7. 14. 19:27삭제
알케인 계열에서, 머무름지수 = 100*탄소수
④ n-Heptane = 100*7= 700
73. 길이 30.0cm의 분리관을 사용하여 용질 A와 B를 분석하였다. 용질 A와 B의 머무름 시간은 각각 13.40분과 16.40분이고 봉우리 너비(4τ)는 각각 1.25분과 1.38이었으며 머물지않는 화학종은 1.40분 만에 통과하였다. 선택인자(α)는 얼마인가?
- ① 0.80
- ② 1.25
- ③ 10.72
- ④ 11.88
등록된 댓글이 없습니다.
74. Pt 산화전극을 사용하여 Fe2+를 전기량으로 적정하려고 한다. 이에 대한 설명으로 틀린 것은?
- ① Fe2+의 농도가 감소하면서 일정전류를 위해서는 전자전위를 증가시켜야 한다.
- ② 정전류기(galvanostats)를 사용하여 일정전류를 유지한다.
- ③ 물의 전기분해가 일어나면 물을 더 첨가하여 농도가 묽어짐을 방지한다.
- ④ 분석물질을 100% 전류효율로 산화시키거나 환원시키기 위해서 보조시약을 사용한다.
등록된 댓글이 없습니다.
75. 금속 Zn 전극과 0.1M ZnCl2 수용액 그리고 Cl2와 0.1M HCl 및 탄소 막대 전극을 이용하여 다음과 같이 전지를 구성하였다. 이에 대한 설명으로 틀린 것은?
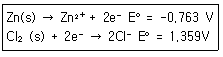
- ① 환원전극(Cathode) 반응은 Cl2(g)+2e-→2Cl-이다.
- ② 산화전극(Anode) 반응은 Zn(s)→Zn2++2e-이다.
- ③ 이 전지의 표준전위는 0.596V이다.
- ④ 이 전지의 반응은 Zn(s)+Cl2(g)→Zn2+(aq)+2Cl-(aq)이다.
ala2024. 7. 14. 19:49삭제
③ E°=E₊-E₋ = 1.359- (-0.763) = 2.122V
표준전위 E= E°+ (0.0592/n)*log([Ox]/[Red])
= 2.122V + (0.0592/2) *log(0.1/0.1) =2.122V
①0.1M HCl → 표준환원전위 양의 값인 Cl은 산화제[Ox]로, 자신은 환원
②0.1 M ZnCl₂ →표준환원전위 음의 값인 Zn은 환원제[Red]로, 자신은 산화
76. 기체 크로마토그래피 분리법에서 사용되는 운반 기체로 부적당한 것은?
- ① He
- ② N2
- ③ Ar
- ④ Cl2
등록된 댓글이 없습니다.
77. 고성능액체크로마토그래피에서 분리효능을 높이기 위하여 사용하는 방법으로 극성이 다른 2~3가지 용매를 선택하여 그 조성을 연속적 혹은 단계적으로 변화하며 사용하는 방법은?
- ① 기울기 용리(gradient elution)
- ② 온도 프로그램(temperature programmimg)
- ③ 분배 크로마토그래피(partition chromatography)
- ④ 역상 크로마토그래피(reversed-phase chromatography)
등록된 댓글이 없습니다.
78. 크로마토그래피에서 관의 분리능을 향상시키기 위한 방법으로 가장 거리가 먼 것은?
- ① 이론단의 수를 높인다.
- ② 선택인자를 크게 한다.
- ③ 용량인자를 크게 한다.
- ④ 이동상의 유속을 빠르게 한다.
등록된 댓글이 없습니다.
79. 고체표면의 원소 성분을 정량하는데 주로 사용되는 원자 질량분석법은?
- ① 양이온 검출법과 음이온 검출법
- ② 이차이온 질량분석법과 글로우 방전 질량분석법
- ③ 레이저 마이크로탐침 질량분석법과 글로우 방전 질량분석법
- ④ 이차이온 질량분석법과 레이저 마이크로탐침 질량분석법
등록된 댓글이 없습니다.
80. C, Cl 원자를 한 개씩 함유하는 화합물에서 M. M+1, M+2, M+3 봉우리들의 상대적 크기로 가장 타당한 것은? (단, M은 분자 봉우리를 나타내며, 동위원소 존재비는 Cl35:Cl37=75:25, C12:C13=99:1이다.)
- ① M:M+1:M+2:M+3-99:1:25:21
- ② M:M+1:M+2:M+3-99:1:25:0.33
- ③ M:M+1:M+2:M+3-99:1:33:1
- ④ M:M+1:M+2:M+3-99:1:33:0.33
ala2024. 7. 14. 19:59삭제
M = 75*99 = 7425
M+1 = 75*1 =75
M+2 = 25*99 = 2445
M+3 = 25*1 = 25
7425 : 75 : 2475 : 25 = 99 : 1 : 33 : 0.33