9급 지방직 공무원 화학(2017. 6. 17.) 시험일자 : 2017년 6월 17일
1. 다음 중 산화-환원 반응이 아닌 것은?
- ① 2Al+6HCl→3H2+2AlCl3
- ② 2H2O→2H2+O2
- ③ 2NaCl+Pb(NO3)2→PbCl2+2NaNO3
- ④ 2NaI+Br2→2NaBr+I2
등록된 댓글이 없습니다.
2. 주기율표에서 원소들의 주기적 경향성을 설명한 내용으로 옳지 않은 것은?
- ① Al의 1차 이온화 에너지가 Na의 1차 이온화 에너지보다 크다.
- ② F의 전자 친화도가 O의 전자 친화도보다 더 큰 음의 값을 갖는다.
- ③ K의 원자 반지름이 Na의 원자 반지름보다 작다.
- ④ Cl의 전기음성도가 Br의 전기음성도보다 크다.
등록된 댓글이 없습니다.
3. 온도와 부피가 일정한 상태의 밀폐된 용기에 15.0mol의 O2와 25.0mol의 He가 들어있다. 이 때, 전체 압력은 8.0atm이었다. O2 기체의 부분 압력[atm]은? (단, 용기에는 두 기체만 들어 있고, 서로 반응하지 않는 이상 기체라고 가정한다)
- ① 3.0
- ② 4.0
- ③ 5.0
- ④ 8.0
등록된 댓글이 없습니다.
4. Al과 Br2로부터 Al2Br6가 생성되는 반응에서, 4mol의 과 8mol의 Br2로부터 얻어지는 Al2Br6의 최대 몰수는? (단, 가 유일한 생성물이다)
- ① 1
- ② 2
- ③ 3
- ④ 4
등록된 댓글이 없습니다.
5. 이온 결합과 공유 결합에 대한 설명으로 옳지 않은 것은?
- ① 격자 에너지는 이온 화합물이 생성되는 여러 단계의 에너지를 서로 곱하여 계산한다.
- ② 이온의 공간 배열이 같을 때, 격자 에너지는 이온 반지름이 감소할수록 증가한다.
- ③ 공유 결합의 세기는 결합 엔탈피로부터 측정할 수 있다.
- ④ 공유 결합에서 두 원자 간 결합수가 증가함에 따라 두 원자 간 평균 결합 길이는 감소한다.
등록된 댓글이 없습니다.
6. 0.100M의 NaOH수용액 24.4mL를 중화하는데 H2SO4수용액 20.0mL를 사용하였다. 이 때, 사용한 H2SO4수용액의 몰 농도는?
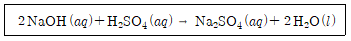
- ① 0.0410
- ② 0.0610
- ③ 0.122
- ④ 0.244
등록된 댓글이 없습니다.
7. 다음 반응은 500°C에서 평형 상수 K=48이다. 같은 온도에서 10L 용기에 H2 0.01mol, I2 0.03mol, HI 0.02mol로 반응을 시작하였다. 이 때, 반응 지수 Q의 값과 평형을 이루기 위한 반응의 진행 방향으로 옳은 것은?
- ① Q=1.3, 왼쪽에서 오른쪽
- ② Q=13, 왼쪽에서 오른쪽
- ③ Q=1.3, 오른쪽에서 왼쪽
- ④ Q=13, 오른쪽에서 왼쪽
등록된 댓글이 없습니다.
8. 다음 알코올 중 산화 반응이 일어날 수 없는 것은?
- ①

- ②
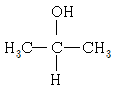
- ③

- ④
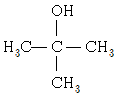
등록된 댓글이 없습니다.
9. 다음은 어떤 갈바니 전지(또는 볼타 전지)를 표준 전지 표시법으로 나타낸 것이다. 이에 대한 설명으로 옳은 것은?
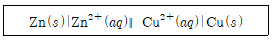
- ① 단일 수직선(|)은 염다리를 나타낸다.
- ② 이중 수직선() 왼쪽이 환원 전극 반쪽 전지이다.
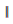
- ③ 전지에서 CU2+는 전극에서 로 환원된다.
- ④ 전자는 외부 회로를 통해 환원 전극에서 산화 전극으로 흐른다.
등록된 댓글이 없습니다.
10. 다음은 25℃, 수용액 상태에서 산의 세기를 비교한 것이다. 옳은 것만을 모두 고른 것은?
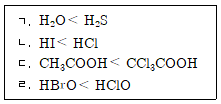
- ① ㄱ, ㄴ
- ② ㄷ, ㄹ
- ③ ㄱ, ㄷ, ㄹ
- ④ ㄴ, ㄷ, ㄹ
등록된 댓글이 없습니다.
11. 화석 연료는 주로 탄화수소(CnH2n+2)로 이루어지며, 소량의 황, 질소 화합물을 포함하고 있다. 화석 연료를 연소하여 에너지를 얻을 때, 연소 반응의 생성물 중에서 산성비 또는 스모그의 주된 원인이 되는 물질이 아닌 것은?
- ① CO2
- ② SO2
- ③ NO
- ④ NO2
등록된 댓글이 없습니다.
12. 다음 원자들에 대한 설명으로 옳은 것은? (순서대로 원자 번호, 양성자 수, 전자 수, 중성자 수, 질량수)
- ①

- ②

- ③

- ④

등록된 댓글이 없습니다.
13. 다음 화학 반응식을 균형 맞춘 화학 반응식으로 만들었을 때, 얻어지는 계수 a, b, c, d의 합은? (단, a, b, c, d는 최소 정수비를 가진다)
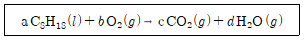
- ① 60
- ② 61
- ③ 62
- ④ 63
등록된 댓글이 없습니다.
14. 다음은 중성 원자 A~D의 전자 배치를 나타낸 것이다. A~D에 대한 설명으로 옳은 것은? (단, A~D는 임의의 원소 기호이다)
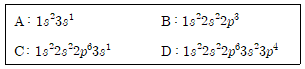
- ① A는 바닥 상태의 전자 배치를 가지고 있다.
- ② B의 원자가 전자 수는 4개이다.
- ③ C의 홀전자 수는 의 홀전자 수보다 많다.
- ④ C의 가장 안정한 형태의 이온은 C+이다.
등록된 댓글이 없습니다.
15. 메테인(CH4)과 에텐(C2H4)에 대한 설명으로 옳은 것은?
- ① ∠H-C-H의 결합각은 메테인이 에텐보다 크다.
- ② 메테인의 탄소는 sp2혼성을 한다.
- ③ 메테인 분자는 극성 분자이다.
- ④ 에텐은 Br2와 첨가 반응을 할 수 있다.
등록된 댓글이 없습니다.
16. 0.100 M CH3COOH(Ka=1.80×10-5) 수용액 20.0mL에 0.100 M NaOH 수용액 10.0mL를 첨가한 후, 용액의 pH를 구하면? (단, log1.80=0.255이다)
- ① 2.875
- ② 4.745
- ③ 5.295
- ④ 7.875
등록된 댓글이 없습니다.
17. 다음은 오존(O3)층 파괴의 주범으로 의심되는 프레온-12(CCl2F2)와 관련된 화학 반응의 일부이다. 이에 대한 설명으로 옳지 않은 것은?
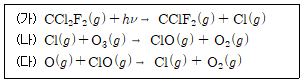
- ① (가) 반응을 통해 탄소()는 환원되었다.
- ② (나) 반응에서 생성되는 에는 홀전자가 있다.
- ③ 오존(O3) 분자 구조내의 π결합은 비편재화되어 있다.
- ④ 오존(O3) 분자 구조내의 결합각 ∠O-O-O은 180°이다.
등록된 댓글이 없습니다.
18. 몰질량이 56g/mol인 금속 M 112g을 산화시켜 실험식이 MxOy인 산화물 160g을 얻었을 때, 미지수 x, y를 각각 구하면? (단, O의 몰질량은 16g/mol이다)
- ① x=2, y=3
- ② x=3, y=2
- ③ x=1, y=5
- ④ x=1, y=2
등록된 댓글이 없습니다.
19. H2와 ICl이 기체상에서 반응하여 I2와 HCl을 만든다. 이 반응은 다음과 같이 두 단계 메커니즘으로 일어난다. 전체 반응에 대한 속도 법칙으로 옳은 것은?
- ① 속도=k[H2][ICl]2
- ② 속도=k[HI][ICl]2
- ③ 속도=k[H2][ICl]
- ④ 속도=k[HI][ICl)
등록된 댓글이 없습니다.
20. 다음 화합물들에 대한 설명으로 옳은 것은?
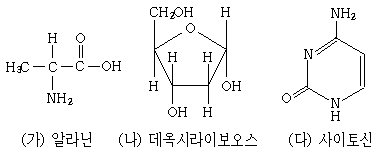
- ① (가)는 뉴클레오타이드를 구성하는 기본 단위이다.
- ② (가)는 브뢴스테드-로우리 산과 염기로 모두 작용할 수 있다.
- ③ (나)는 단백질을 구성하는 기본 단위이다.
- ④ 데옥시라이보핵산(DNA)에서 (다)는 인산과 직접 연결되어 있다.
등록된 댓글이 없습니다.